センター長:伊藤 誠二
慢性疼痛は二足歩行を獲得した人類に不可避の運動器系(骨、関節、筋肉、神経など)疾患です。日本で約1,700万人が慢性疼痛に罹患し、
慢性疼痛患者の77%は慢性痛の治療に満足していないことが最近の大規模調査で明らかにされています。慢性痛は鎮痛薬、理学療法などの保存療法が
取られていますが、身体的、心因的、社会的要因が複雑に絡み合うため、特に神経因性疼痛は有効な治療法がなく難治性であると考えられ、関西医科大学の
心療内科では全人的医療を行っています。2005年、本事業の共同研究者、稲田有史博士は、150年前から現在に至るまで治らないとされてきた神経損傷による
慢性疼痛患者の激痛を人工神経を用いた神経再生で治すことに世界で初めて成功し、国内外で注目を集めています。最近の基礎研究でも、慢性疼痛の原因の
少なくとも一部は運動器系に属する末梢組織上の感覚受容器にあり、その原因を除くことにより治ると考えるようになってきています。滝井キャンパスの
ブレインメディカルサービス(BMS)、総合リハビリテーションセンターでは、科を超えた共同診療体制やコメディカルとの緊密な協力体制があり、
感覚・運動器系の疾患に対して総合的に対処し、豊富な診療実績を有しています。この度、平成18年度から学術フロンティア推進事業のご支援により、
ブレインメディカルリサーチセンター(BMRC)を設置して、修復再生医学による神経系難治性疾患の治療に向けた横断的トランスレーショナル研究を
推進することになりました。本事業の特徴は、遺伝子導入や幹細胞による「再生能」に加えて、神経系の「可塑性」や「自己修復・再生能」に焦点を当て、
その正常な機能を維持・修復させることを目標として、関西医科大学のBMSを含めた臨床系8講座と基礎系8講座、附属生命医学研究所3部門
が連携してトランスレーショナル研究を推進することにあります。
基礎系講座では神経系の修復・再生機構、変性機構とその予防に関する研究、組織幹細胞の同定と評価系の確立、臨床系講座では神経修復・再生による治療可能な
対象疾患の病態解明と幹細胞の臨床応用に向けた動物実験を計画しています。BMRCでは動物愛護の観点からもできるだけ少ない動物で治療効果の
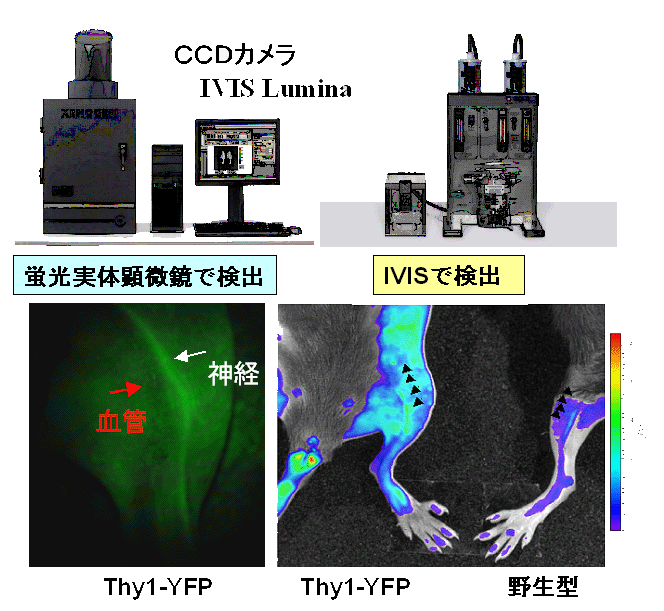
有効性を評価するために、神経系が選択的に光るマウスや発光現象あるいは蛍光物質を利用して標識した細胞をさまざまな経路から注入した後、
リアルタイムにイメージングして追跡できるin vivoイメージング解析装置を設置しています。
さらに本事業は専門性の異なる大阪医科大学麻酔科と神経再生にすぐれた実績を有する稲田病院との共同研究も推進していますが、今後その他の施設とも
連携して地域に密着したネットワークが構築できる発展性を有しています。高齢化社会を迎える日本にあって、感覚・運動器系の機能の維持・修復は医療・
介護費の軽減という医療経済の観点だけでなく、患者個々の生活の質(QOL)の向上からも重要な貢献ができると期待しています。
 図はクリックすると別窓で拡大表示されます
図はクリックすると別窓で拡大表示されます1)in vivo末梢神経再生のモデルの確立と再生機構の解析
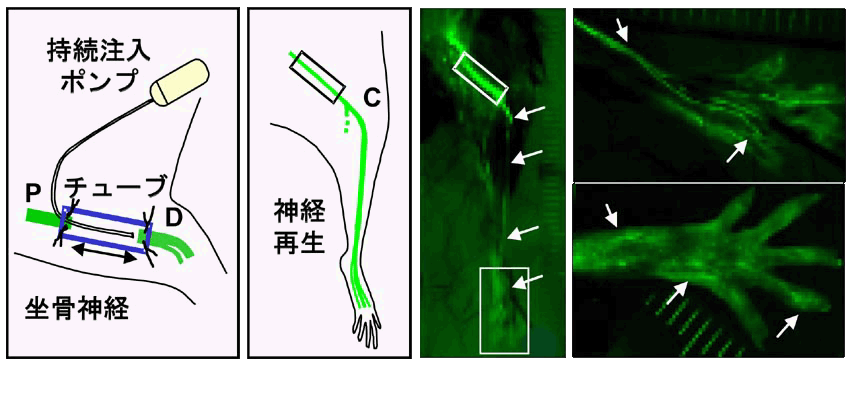
関節リウマチのような慢性炎症性疾患には抗炎症薬COX-2阻害薬や抗TNF抗体製剤、片頭痛にはトリプタン製剤など有効な治療薬が開発される一方、稲田博士は神経損傷によるカウザルギー患者の激痛を人工神経を用いた神経再生で治すことに成功しました。これら最近の難治性慢性疼痛の治療の成功は、難治性慢性疼痛の患者の中に、社会的、心的要因より身体的要因の比重が大きく、神経再生により治療可能な患者が存在することを意味していますが、神経再生には長い年月を要します。末梢神経の修復・再生には、増殖因子、反応の場と細胞因子の3因子が重要です。神経損傷後におこる神経再生の過程を経時的かつ非侵襲的に評価するために、in vivo イメージング装置(図1)を用いて神経細胞、軸索特異的に蛍光タンパク質YFPを発現するThy1-YFPトランスジェニックマウスの神経を可視化しました。再生モデルを用いて生理活性物質や医療素材の有効性を評価するために、稲田博士の治療方法に準拠して、坐骨神経切断後に神経両端をシリコンチューブに縫合し、さらに、チューブ内に浸透圧ポンプを用いて持続的に試薬(神経成長因子をはじめとするさまざまな物質)を投与する末梢神経再生モデルを確立しました(図2)
|
|
| 図1 in vivoイメージングシステム |
図2 神経が特異的に光るThy1-YFPマウスを用いた 末梢神経の再生モデルの確立 |
手術後1‐2週間で消失した神経由来のYFP蛍光が、経時的に伸長し手術8週間後に指先まで到達する以前に、手術後4週目には機械的刺激に対する逃避行動 など機能回復が認められ、神経成長因子でその回復が促進されました。末梢神経の損傷治癒は損傷部位の遠位側のWallerian変性により軸索は分解除去される ことが必要です。 Schwann細胞は軸索のミエリン化に関与する細胞(中枢神経のオリゴデンドロサイトに相当)と関与しない細胞(アストロサイトに相当) の2種類があり、後者の機能を欠損させた(Schwann-/-)マウスでは、術後12週でも神経再生による機能回復が遅れていること、Schwann-/-マウスのシリコン チューブ内に栄養源を浸透圧ポンプで4週間持続的に注入すると、神経再生と機能回復が早まり、野生型マウスに近づくこと、反対に野生型マウスのシリコン チューブ内に軸索の栄養源の取り込みに関与するトランスポーター阻害薬を持続注入すると機能回復が遅延することから、Schwann細胞から神経細胞への エネルギー供給が神経再生に重要であることが明らかになりました。これらの結果は、末梢神経の再生では神経損傷により末梢組織で分泌・軸索輸送される 神経成長因子、神経細胞−Schwann細胞の相互作用と神経再生の場で分泌される生理活性物質が重要であることを示しています。現在、生きた動物の 神経再生を随時、長期間モニタリングできるThy1-YFPトランスジェニックマウスによる末梢神経再生モデルを用いて、さまざまな物質や材料の神経再生に 対する評価を行い、損傷神経の修復再生のトランスレーショナル研究を推進しています。
2)神経幹細胞の局在と骨髄細胞移植
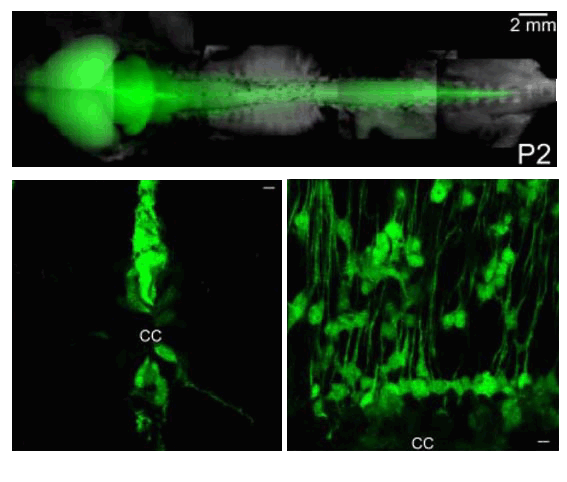
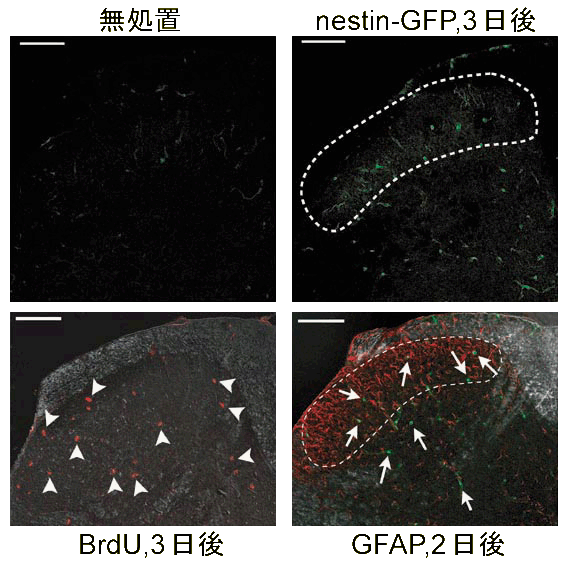
1990年代に、神経幹細胞がヒトをはじめとして成体の脳でみつかりました。しかし、その局在は非常に限局されていますので、脳梗塞、パーキンソン病、 脊髄損傷などの治療には骨髄細胞や神経幹細胞の移植が必要となってきます。発生段階では、神経幹細胞はまず神経細胞に分化した後、アストロサイト (グリア=膠細胞の1種)、オリゴデンドロサイト(グリアの1種)に分化することがよく知られていますが、ミクログリアの由来は明確でありません。また、 損傷部位で欠落した神経細胞がグリアに置換されるグリオーシスが脳脊髄障害の不可逆性の元凶と考えられています。脊髄は脳室下帯と同程度のneurosphere(神経球)形成能を有する神経幹・前駆細胞が存在することが知られています。神経幹細胞のマーカーである ネスチンnestinのプロモーターの下流に蛍光タンパク質GFPを発現させたpNestin-GFPトランスジェニックマウスで神経損傷に伴うGFPの発現変化と細胞増殖の マーカーであるBrdUの取り込みを検討しました。pNestin-GFPは生直後の脳神経系全体に発現しています(図3上)が、健常な成体の脊髄では中心管間付近のみ pNestin-GFPの発現が見られます(図3下)。末梢神経損傷3日後に、GFPの発現上昇が神経損傷側の脊髄後角全体で見られました(図4右上)。 平行して神経幹細胞の性質の1つ細胞増殖をBrdUの取り込みで検出しますと、3日後に脊髄後角全体に顕著な上昇が認められ(図4左下、矢頭)、 1週間で漸減しました。GFPの発現(矢印)の一部はアストログリアのマーカーGFAP(図4右下)や神経細胞のマーカーNeuNで共染するものもあります。 pNestin-GFPとはミクログリアのマーカーとは共染しませんが、脊髄で神経損傷に伴うBrdUの取り込みはミクログリアでもみられたことから、神経損傷により ミクログリアの少なくとも一部は脊髄で増殖することがわかりました。神経損傷に伴い急性期に産生されるATP、プロスタグランジン(PG)、 一酸化窒素(NO)など細胞間情報伝達物質が細胞増殖するnestin陽性細胞に作用することが示しましたが、脊髄損傷における神経幹細胞の分裂増殖、神経回路の 再構築への関与はこれからの課題です。また、脳内在性の神経幹・前駆細胞を探索して、終脳皮質に神経幹・前駆細胞広く散在すること、その特徴を明らかにしました。
|
|
|
図3 (上)生後2日目の神経幹細胞の分布 (山口正洋東京大学准教授のとの共同研究) (下)脊髄中心管(CC)付近でのnestin陽性細胞の局在 |
図4 神経損傷に伴う脊髄後角でのnestin 発現上昇(右上)とBrdU取り込み(左下) |
神経損傷による神経幹細胞の急激な増殖はほとんど全ての脳の部位で認められないことから、アルツハイマー病、筋萎縮性側索硬化症、脳梗塞と変性椎間板のモデルマウスに 骨髄移植する臨床応用にむけた動物実験を行う一方、ウイルスを用いた遺伝子導入による内耳有毛細胞の再生にも取り組み、Atoh1遺伝子導入で聴力の改善が見られて います。頸髄損傷患者で運動完全麻痺の重症患者5症例に対して、臨床試験「培養自家骨髄間質細胞移植による脊髄再生治療の検討」を実施し、3症例で著効が認め られました。しかし、症例数の少ない中で一例ごとに臨床試験の成果について有効無効を論じることは難しいことです。対象患者、移植細胞を含めた治療法、 改善開始時期や改善の評価などプロトコールを作成し、先進医療として多施設共同研究にて多数の症例に取り組む必要があります。
3)機能的、可逆的な慢性疼痛維持機構の解明
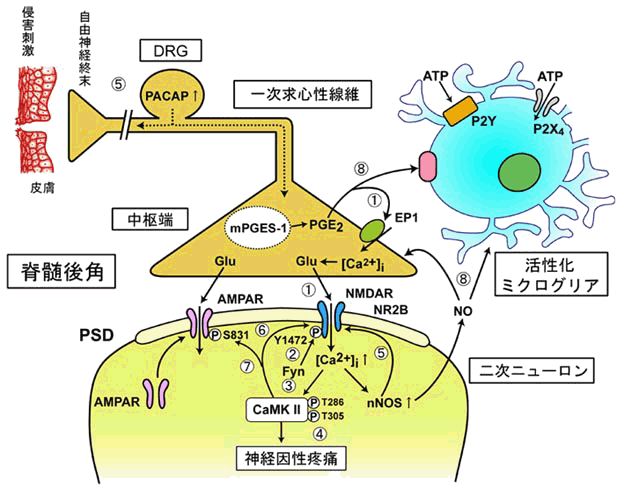
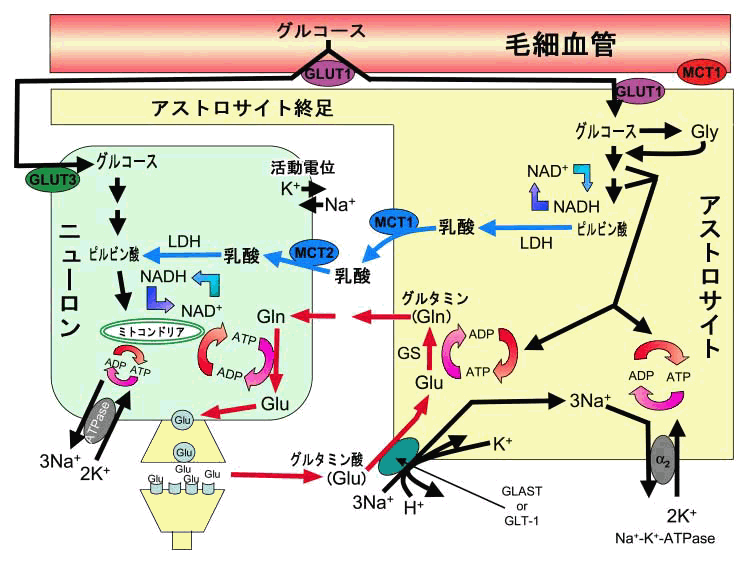
神経因性疼痛モデルの脊髄で、末梢の神経損傷部位からの持続的な侵害入力とシナプス終末からのグルタミン酸の放出が中枢性感作(神経可塑的変化)を維持させ、 神経因性疼痛が持続することを明らかにしました。図5に示しますように、活性化したNMDAグルタミン酸受容体を介するCa2+流入による二次ニューロンの 細胞内Ca2+濃度のグラジエント形成が神経型一酸化窒素合成酵素 (nNOS) とカルモジュリンキナーゼII (CaMKII) の活性化して、後シナプス膜肥厚 (PSD)への トランスロケーション(⑤と⑦)させます。また、健常時の一方向性の神経伝達に対して、神経損傷の神経終末で産生されるNOとプロスタグランジンE2 (PGE2)などの生理活性物質(⑧)は、逆行性、順行性メッセンジャーとしてシナプス終末からのグルタミン酸の持続的な遊離を引き起こします。その結果、標的分子の リン酸化やNMDA受容体複合体タンパクの解離会合のダイナミクス、さらにミクログリアの遊走抑制など細胞間メッセンジャーとして作用して脊髄後角を反応の場 に変えることにより弱い刺激でも痛みを感じる中枢性感作状態なることを数多くの遺伝子改変マウスで明らかにしました。最近、血流が減少している損傷した 神経にアストロサイトがエネルギーを供給して神経再生を促進させることがわかってきています(図6)。この可逆的な慢性疼痛の維持機構は、150年間治らない とされてきた神経損傷によるカウザルギー患者の長年持続した激痛が治った根拠を与えるものです。
|
|
|
図5 皮膚からの痛覚伝達経路と 脊髄後角での慢性疼痛の維持機構 |
図6 アストロサイトから神経細胞へのエネルギー供給の模式図 |
4)神経系難治性疾患の病態解明と治療への応用
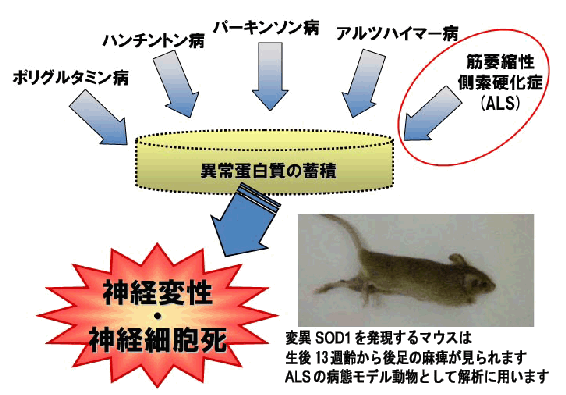
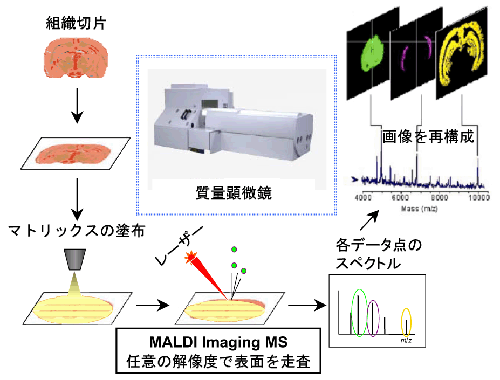
アルツハイマー病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症(ALS)など神経系難治性疾患の多くは、リン酸化やユビキチン化を受けた異常蛋白質が蓄積し、 神経原線維変化や細胞内封入体などの特徴的な病理変化を示します。ALSは脊髄前角の運動神経細胞が変性脱落し、 発症後数年以内に呼吸筋麻痺によって死に至る難病です。 遺伝子改変ALSモデルマウス(図7)とヒトALS患者剖検脳で核膜孔複合体の分布異常を明らかにし、 ALSがアルツハイマー病と共通の神経変性機序である可能性を示しました。ALSの原因遺伝子としてオプチニューリンoptineurinを同定し、炎症に関与する NF-ΚB阻害薬が治療に使える可能性を示しました。さらに、ALSモデルマウスでフリーラジカルスカベンジャーが用量依存的に運動障害の進行を抑制することを示しました。その結果、 ヒトALS患者の臨床試験の実施に至りました。細胞内封入体を構成する蛋白質をはじめ、脂質、糖鎖などを網羅的に解析することは従来の生化学的、免疫組織化学的手法では困難でした。MALDIによる質量分析装置を 二次元化して分子イメージングを行う質量顕微鏡(図8)が最近開発されました。質量顕微鏡は質量の情報と位置情報を同時に測定することができるため、原理的には 重さのあるすべての物質分布が同時に観察可能となりました。試料を高解像度の顕微鏡で観察し、その場で注目した個所を直接迅速に質量分析することができるこの最新の 機器を用いて神経系難治性疾患の病態の解明を進めています。心療内科、神経内科、眼科、耳鼻科など臨床系講座とのトランスレーショナル研究を推進しています。 神経系難治性疾患の病態解明のため、京都大学iPS細胞研究所をはじめ外部研究機関と共同研究を推進しています。
|
|
| 図7 神経系難治性疾患の共通する分子機構 | 図8 質量顕微鏡による分子イメージングと標的マーカーの探索 |